La purificación de fragmentos de anticuerpos, como los dominios de unión al antígeno (Fab), los fragmentos de región variable de simple cadena (ScFv) y los dominios variables de cadena pesada (nanoanticuerpos), se han convertido en alternativas terapéuticas y diagnósticas cada vez más importantes a los anticuerpos monoclonales de longitud completa (MAbs). ) para multitud de enfermedades.
Avances en la purificación de fragmentos de anticuerpos
Mientras que el proceso de purificación de los MAb está bien establecido y es fácil de escalar basado en el paso de captura con proteína A, la purificación de fragmentos de anticuerpos está apenas iniciando la estandarización del proceso de purificación. El candidato más prometedor para la captura eficaz de aquellos fragmentos que contienen una cadena ligera kappa, es la cromatografía de afinidad con proteína L en el proceso de purificación ( 1 ).

Para establecer un proceso de captura eficaz en la purificación de fragmentos de anticuerpos, comparamos las capacidades de dos resinas diferentes de proteína L en columna única y luego investigamos su rendimiento mediante cromatografía multicolumna (MCC) para mejorar aún más el rendimiento del proceso. La combinación de una resina con alta capacidad de carga y la tecnología MCC proporcionó grandes ahorros de resina y solución tampón, al tiempo que redujo los costos de operación del proceso para la fabricación de materiales clínicos.
Fragmentos de anticuerpos y resinas
La resina Toyopearl AF r-protein L-650F de Tosoh Bioscience se basa en partículas de polimetacrilato. Ofrece una capacidad de unión estática (SBC) de 54 mg/ml para fragmentos Fab y permanece estable a un pH de 2 a 12. A modo de comparación, también realizamos todos los experimentos con la resina Capto L de Cytiva.
Para preparar una solución de materia prima de fragmento de anticuerpo, el MAb purificado con proteína A se mezcló con papaína activada, que escindió las moléculas después del residuo de histidina (His-228) en una región bisagra para separar sus fragmentos Fab individualmente del fragmento cristalizable (Fc). A la mezcla de reacción se le añadió sobrenadante de cultivo celular de células de ovario de hámster Chino (CHO) para simular una materia prima con una concentración final de fragmento Fab de 2,23 mg/ml conteniendo impurezas que normalmente están presentes antes del paso de captura.
Purificación por lotes:
Después de la optimización del método, aplicamos las siguientes condiciones para la cromatografía con ambas resinas utilizando columnas de 2,4 ml con alturas de lecho de 7 cm:
- Equilibrio: 5 volúmenes de columna (CV) de fosfato de sodio 100 mM, pH 7,0
- Carga: CV variable de alimentación que contiene fragmentos Fab+
- Lavado 1: 10 VC de fosfato de sodio 100 mM, pH 7,0
- Lavado 2: 5 VC de 100 mM acetato de sodio, pH 5,5
- Elución: 5 CV de glicina 100 mM con ácido clorhídrico (HCl), pH 2,5
- Limpieza in situ (CIP): 5 CV de hidróxido de sodio 50 mM
- Reequilibrio: 5 CV de fosfato de sodio 100 mM, pH 7.0.
Las columnas se cargaron al 85% de su capacidad de unión dinámica (DBC) previamente determinada, para garantizar que no se pierda ningún producto durante el paso de carga. Esto dio como resultado un volumen de carga de 15 CV (33,5 mg/ml de resina) para la resina Tosoh y 6 CV (13,4 mg/ml de resina) para el comparador. El pico de elución se recogió y analizó mediante cromatografía líquida de ultra alta presión por exclusión de tamaño (UHPLC) para el perfil de impurezas y cromatografía analítica de proteína L para la concentración. Calculamos la recuperación del producto a partir de los resultados de esos análisis.
Purificación por cromatografía continua:
El método de purificación anterior se tradujo a un proceso MCC utilizando la herramienta ProComposer Method Wizard de Tosoh Bioscience, con el objetivo de mejorar la productividad del proceso y al mismo tiempo disminuir el consumo de solución tampón. Para lograr ese objetivo, se equipó un sistema Octave BIO (Foto 1) con cinco columnas pre-empaquetadas SkillPak BIO de 1 ml (todas de Tosoh Bioscience) que conteniendo las respectivas resinas de proteína L.
El sistema Octave BIO consta de seis bombas, un bloque de válvulas de conmutación y un conjunto de detectores. Cada bomba está designada para un buffer requerido en el proceso. A través del bloque de válvulas se pueden acceder hasta ocho columnas mediante diferentes bombas en paralelo o conectadas entre sí en serie. El conjunto de detectores proporciona un control preciso de hasta cuatro flujos de proceso diferentes con respecto a la absorción de UV, la conductividad y el pH.
Para el proceso MCC, conectamos tres de las cinco columnas en serie a través del bloque de válvulas. Eso permitió aumentar las cantidades de carga y el uso de la capacidad total de resina al capturar el producto excedente en las columnas posteriores. Mientras esas tres columnas están en la fase de carga, las dos restantes pasan por las fases de lavado y elución, luego CIP y equilibrio. Una vez que la primera columna de la serie de carga está completamente cargada, los puertos de la columna se colocan en posición contra la corriente de flujo. Se ha demostrado que configuraciones similares son más efectivas para los procesos de captura ( 2 ). Cada experimento de MCC consistió en cinco ciclos en los que las columnas giraban a través de los diferentes pasos del proceso.
En MCC, el riesgo de perdida del producto es menor durante la carga debido a las columnas de carga secundarias. Por lo tanto, cargamos las columnas al 85 % de sus SBC determinados previamente, lo que dio como resultado masas de carga de 45,3 mg/ml de resina para la resina Tosoh y 21,62 mg/ml de resina para el comparador. Ambos pasaron por dos ejecuciones, con tiempos de residencia durante la carga que variaron de 0,5 minutos a 0,25 minutos.
Captura intensificada de proteína L
Comparamos los resultados de estos experimentos en función de varios parámetros clave (Tabla 1). Claramente, el uso de tres columnas de carga en el sistema Octave BIO resultó eficaz para mantener una alta recuperación y al mismo tiempo aumentar la capacidad de uso de las resinas en comparación con los procesos por lotes. Al comparar los resultados de MCC con diferentes tiempos de residencia, encontramos que 0,5 minutos son favorables para una alta recuperación, un valor que también habíamos encontrado en estudios anteriores sobre la captura con proteína A ( 2 ). Sin embargo, para los procesos centrados en la productividad, un tiempo de residencia de 0,25 minutos aceleraría la ejecución y al mismo tiempo mantendría la recuperación en niveles aceptables.
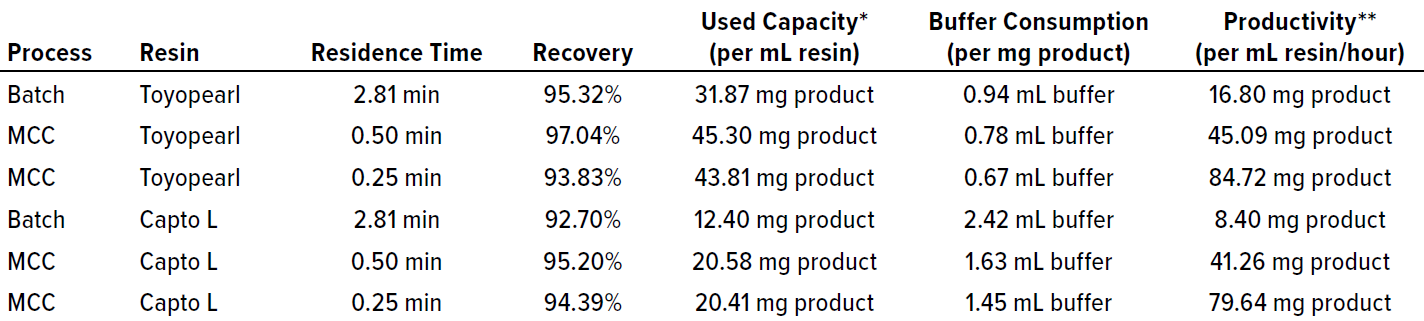
Tabla 1: Comparación de parámetros de evaluación para diferentes ejecuciones de purificación de Fab.
* Expresa cuánto producto se puede recuperar por ejecución con respecto al volumen del lecho de resina.
** Expresa la eficiencia del proceso medida en términos de masa de producto procesado por unidad de volumen de resina a lo largo del tiempo.
Maximizar el uso de la capacidad de resina influye positivamente en la economía del proceso al aumentar la masa de proteína que se puede purificar por litro de resina comprada. En MCC, la primera columna de la fase de carga se puede cargar con más proteína porque las columnas siguientes unirán el producto que podría no ser capturado en la primera. Por tanto, el uso de la capacidad se puede mejorar en un 42% para la resina Tosoh y en un 66% para el comparador. Nuestro estudio reveló que se puede cargar aproximadamente 2,2 veces más masa proteica en la resina Tosoh que en la resina Cytiva, lo que puede atribuirse a sus diferentes SBC.
Al comparar el consumo de buffer de los métodos cromatográficos discontinuos y multicolumna, queda claro que el MCC contribuye significativamente a reducir el consumo de productos químicos y/o la generación de residuos mediante un mejor uso de la resina. Tal mejora en la economía del proceso se puede implementar usando una resina con mayor capacidad de carga, como se ilustra en la comparación en este documento.
La productividad depende principalmente de la duración del proceso. La reducción del tiempo de residencia durante la carga de la columna aumenta directamente la productividad en casi el mismo factor. En comparación con las ejecuciones por lotes, MCC aumenta la productividad en aproximadamente un 170 % mediante un tiempo de residencia de carga más corto (0,5 minutos), y en otro 235 % mediante un tiempo de residencia más corto (0,25 minutos). La reducción en la duración del proceso se refleja en los costos operativos porque la productividad y la eficiencia del proceso son proporcionales al ahorro de resina y tiempo.
Nuestra comparación destaca el beneficio de convertir el paso de captura de fragmentos de anticuerpos en un proceso continuo. El mayor uso de la capacidad de carga, mayor productividad y menor consumo de solución tampón demostrados en este documento mejoran la economía del proceso y aumentan la viabilidad de purificar grandes cantidades de fragmentos Fab en un tiempo reducido. El sistema Octave BIO facilita dicha transición del procesamiento por lotes al continuo mediante su manejo intuitivo y simplificando la transferencia de métodos.
Referencias
1 Bumelis VA, Markmann A. Desarrollo de procesos biofarmacéuticos de alto valor. Euro. Biotecnología . 22, primavera de 2023: 54–55; https://european-biotechnology.com/up-to-date/backgrounds-stories/story/high-value-biopharma-process-development.html .
2 Mabry J, et al. Purificación de anticuerpos monoclonales en dos pasos mediante una plataforma de cromatografía continua multicolumna. BioProceso Int. 20(10) 2022: 54–56; https://bioprocessintl.com/sponsored-content/two-step-monoclonal-antibody-purification-using-a-multicolumn-continuous-chromography-platform .
El autor correspondiente Sebastian Thürmann es director de producto para cromatografía multicolumna en Tosoh Bioscience GmbH, Leuschnerpark 4, 64347 Griesheim, Alemania; 49-6155-7043700; [email protected] . Patrick Endres es director de producto de EMEA, Jonas Wege es director de desarrollo de aplicaciones y Egbert Müller es director técnico, todos ellos en Tosoh Bioscience.
Toyopearl y Tosoh Bioscience son marcas comerciales registradas de Tosoh Corporation. Octave es una marca comercial de Tosoh Bioscience Wisconsin, Inc. SkillPak es una marca comercial de Tosoh Bioscience LLC. Capto es una marca registrada de Cytiva.
Fuente: bioprocessintl.com
