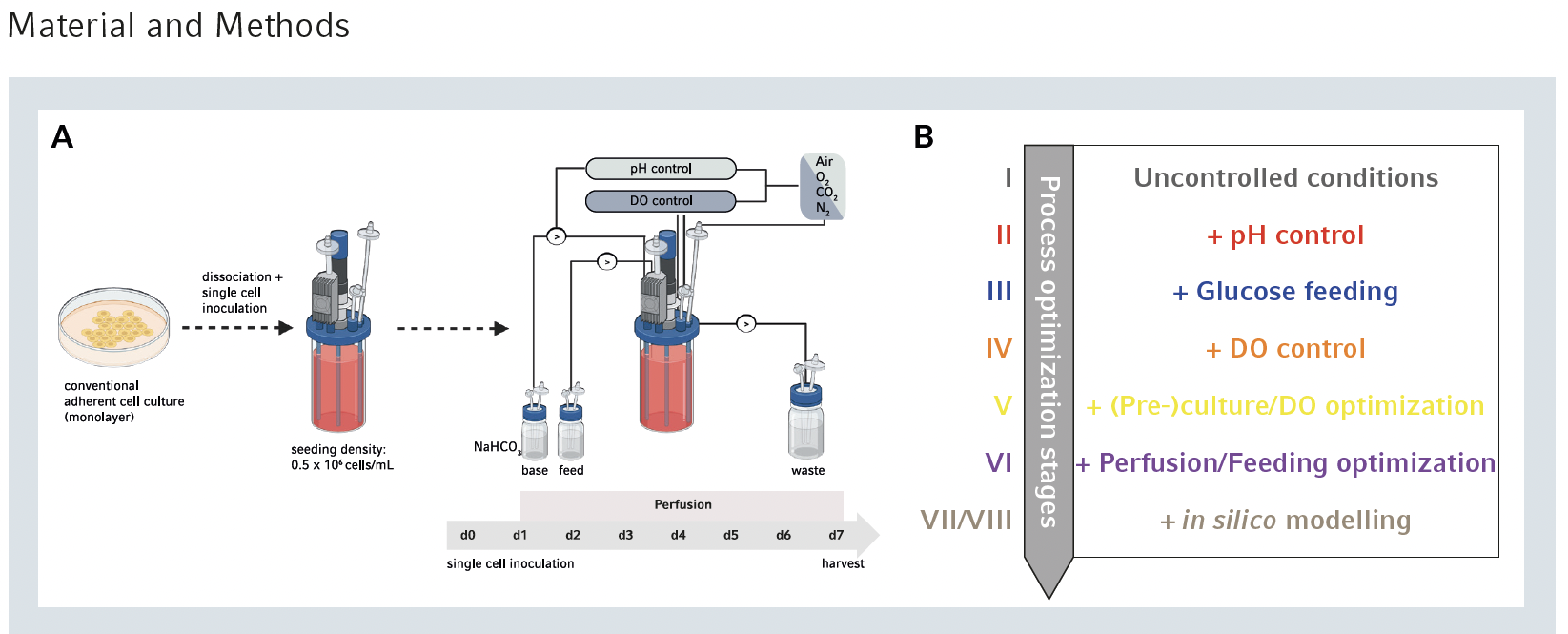
Las células madre humanas pluripotentes inducidas (human Induced Pluripotent Stem Cells, hiPSC) son invaluables para diversas aplicaciones, como el descubrimiento de fármacos y el modelado de enfermedades, pero requieren de la obtención de un gran número de células para poder desarrollarlas. Lograr estas altas densidades celulares es un desafío con los métodos de cultivo 2D, pero los biorreactores de tanque agitado ofrecen un entorno 3D propicio para controlar y optimizar las condiciones de crecimiento de las iPSC.
En una nota de aplicación reciente de Eppendorf, denominada » Aumento del Número de iPSC Mediante la Optimización Sistemática del Proceso de Cultivo «, los investigadores utilizaron biorreactores de tanque agitado para proporcionar un entorno de cultivo 3D propicio para condiciones óptimas de crecimiento de hiPSC. Al emplear DASbox® Mini Bioreactors y el DASbox Mini Bioreactor System y optimizar sistemáticamente los parámetros del proceso, lograron un aumento notable en la densidad celular, superando 10 veces en comparación frente a condiciones no controladas, manteniendo al mismo tiempo las características y la viabilidad de las células madre.
La nota de aplicación describe un proceso de optimización que utiliza ajustes sistemáticos de parámetros y modelado “in silico”. Como resultado, la densidad celular aumentó significativamente y al mismo tiempo se mantuvieron las propiedades y la viabilidad de las células madre. El estudio subraya la importancia de los métodos de cultivo basados en biorreactores para avanzar en la investigación de células madre y sus aplicaciones terapéuticas.
INFLUENCIA DEL PH, LA ALIMENTACIÓN DE GLUCOSA Y EL CONTROL DE DO EN EL CULTIVO DEL BIORREACTOR hIPSC
El estudio utilizó el sistema de mini biorreactor DASbox para monitorear y controlar con precisión el pH, la alimentación con glucosa y los niveles de oxígeno disuelto (DO) en el cultivo. El control del pH se inició con un punto de ajuste de 7,0, lo que dio como resultado valores de pH estables durante todo el experimento y un mayor consumo de glucosa en comparación con las condiciones no controladas. La estrategia de alimentación con glucosa desde el día 3 en adelante aumentó aún más las concentraciones de glucosa pero también elevó los niveles de lactato. El control de DO con un punto de ajuste del 40% desde el primer día proporcionó un suministro de oxígeno más estable, aunque los niveles iniciales de DO fueron más bajos. Diferentes configuraciones de parámetros de crecimiento influyeron en las densidades celulares, y el control del pH y la suplementación con glucosa produjeron aumentos significativos en comparación con las condiciones no controladas. Sin embargo, el control de DO por sí solo no mejoró sustancialmente la densidad celular. El estudio sugiere un efecto compensatorio de la suplementación con DO en momentos posteriores, pero se necesita una mayor adaptación de la estrategia de DO para reducir la pérdida celular temprana y controlar el tamaño de los agregados. En general, los valores de pH controlados y la alimentación con glucosa duplicaron la densidad celular en comparación con los sistemas de cultivo no controlados, lo que destaca el impacto positivo de estos parámetros en el crecimiento celular.
CONTROLAR EL TAMAÑO Y LA VIABILIDAD DEL AGREGADO CELULAR MEDIANTE LA OPTIMIZACIÓN PREVIA AL CULTIVO, LA ADAPTACIÓN DE DO Y EL AJUSTE DE LA AGITACIÓN
Para abordar la pérdida inicial de células y controlar el tamaño de los agregados, se implementó un enfoque de adaptación de parámetros de cuatro etapas. Primero, la optimización previa al cultivo redujo el período de cultivo 2D a 72 horas, lo que resultó en una menor confluencia celular. Segundo, se introdujo una cascada de niveles de DO, manteniendo un nivel de DO inicial del 100% antes de estabilizarlo en el 40%. Tercero, durante la inoculación se añadió el protector para fuerzas de corte Pluronic F-68. Finalmente, la velocidad de agitación se aumentó de 60 a 80, 100 o 120 rpm para controlar el tamaño del agregado. Todos los ajustes de la velocidad de agitación redujeron con éxito la pérdida inicial de células, siendo 80 rpm suficientes para mantener el tamaño del agregado por debajo de 300 μm durante todo el experimento. A pesar de las mayores velocidades de agitación, la viabilidad celular se mantuvo comparable en todas las condiciones. Por lo tanto, se eligieron 80 rpm para equilibrar el control del tamaño de los agregados y las fuerzas de corte mínimas para experimentos posteriores.
Tasa de Alimentación y Perfusión Optimizada.
Para optimizar la alimentación de glucosa y prevenir la acumulación de lactato, la tasa de perfusión media se aumentó gradualmente de 1 a 2 volúmenes de cultivo/día entre los días 2 y 5. Simultáneamente, la concentración de glucosa se elevó de 3,15 a 6,15 g/l entre los días 1 y 3. luego a 6,15 a 7,65 g/L desde el día 4 en adelante. A pesar del aumento esperado en la producción de lactato, los niveles se mantuvieron comparables a los del enfoque sin alimentación optimizada. La densidad celular aumentó a 18 × 10 6 células/ml, casi el doble que el paso de optimización anterior. En general, en comparación con las condiciones no controladas, esta estrategia de optimización integral dio como resultado un aumento de seis veces en la densidad celular al día 7 después de la inoculación en comparación con las condiciones no controladas.
MAYOR OPTIMIZACIÓN DE LA CULTURA MEDIANTE MODELADO IN SILICO.
El control preciso de los parámetros proporcionado por el sistema de mini biorreactores DASbox y la agitación suave de las células con el impulsor de 8 palas dieron como resultado un aumento notable en el número de células madre. Para mejorar aún más la densidad celular y reducir la carga de trabajo de las pruebas de laboratorio, se empleó el modelado in silico . Utilizando el software Berkely-Madonna, los resultados del paso de optimización anterior obtenidos en el laboratorio de cultivo, se incorporaron a un algoritmo para predecir enfoques de optimización de parámetros adicionales.
Ell modelo VII (Tabla 1) predijo una densidad celular de 70 × 10 6 células/ml el día 7, pero los resultados reales alcanzaron 23 × 10 6 células/ml, superando los ensayos anteriores. Sin embargo, un pico inesperado de glucosa en el día 6 indicó la necesidad de seguir perfeccionando este modelo. Luego se desarrolló el modelo VIII (Tabla 1) utilizando resultados de laboratorio de cultivo para el modelo VII, lo que resultó en una coincidencia más cercana entre las densidades celulares previstas (40 × 10 6 células/mL) y reales (33 × 10 6 células/mL). Estos resultados, confirmados en tres cultivos de líneas de células madre diferentes, representaron un aumento de la concentración celular de casi 10 veces en comparación con las condiciones no controladas.
PROPIEDADES DE LAS iPSC CULTIVADAS EN UN BIORREACTOR DE TANQUE AGITADO
Los resultados demuestran que la optimización del proceso mediante un control preciso de los parámetros en un biorreactor de tanque agitado permite un mayor número de células y al mismo tiempo mantiene una sólida viabilidad celular. El análisis de los marcadores de pluripotencia TRA-1-60, SSEA-4, OCT-3/4, NANOG, SOX2 y KI-67 confirmó la retención de las propiedades de las células madre después de 7 días de cultivo. Además, la capacidad de las células madre para diferenciarse en varios tipos de células de las capas germinales endo, meso y ectodermo, se confirmó mediante protocolos convencionales de diferenciación no dirigida y diferenciación específica. La presencia de marcadores específicos de la capa germinal y la inducción reproducible de las progenies sugirieron capacidades de diferenciación intactas. Es importante destacar que no se observaron anomalías cromosómicas en las células derivadas del proceso después de 7 días de cultivo. Estos hallazgos indican colectivamente que la población de células madre pluripotentes mantuvo todas las propiedades clave esperadas incluso después del cultivo a altas densidades celulares logradas mediante la optimización del proceso en un biorreactor de tanque agitado.
CONCLUSIONES
En conclusión, el estudio demuestra la eficacia de utilizar un entorno de crecimiento controlable y ajustable para el cultivo de células madre. Al emplear las capacidades precisas de control de parámetros del sistema DASbox Mini Bioreactor y la adaptación sistemática, las densidades de células madre aumentaron aproximadamente de 3×10 6 células/mL en un entorno no controlado a casi 35×10 6 células/mL, lo que resultó en un número total de células de casi 5×10 9 células en el volumen total de cultivo. El impulsor de 8 palas con inclinación de 60° del Mini Biorreactor DASbox facilitó un mezclado eficiente, el control del tamaño de los agregados y una alta viabilidad celular al tiempo que minimizó la tensión de las fuerzas de corte. Este enfoque de adaptación de parámetros paso a paso ofrece un método eficiente para la optimización y el desarrollo de procesos en el cultivo de células madre dentro de biorreactores, proporcionando una hoja de ruta para superar los obstáculos en el cultivo y avanzar en las aplicaciones de células madre.
Los datos proporcionados en este artículo resumido representan sólo una fracción de la información disponible en la nota de aplicación; descargue la nota de aplicación completa para conocer todos los datos y detalles del estudio.
Para obtener más información, consulte Aumento del Número de iPSC Mediante la Optimización Sistemática del Proceso de Cultivo.
Todos los métodos y resultados de esta nota de aplicación son trabajos publicados por el grupo del Dr. Robert Zweigerdt, Laboratorios de Investigación Leibniz para Biotecnología y Órganos Artificiales, Hannover.
Fuente: Aumento del Número de iPSC Mediante la Optimización Sistemática del Proceso de Cultivo

